Ngày 13/7 (giờ địa phương), Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) đã cấp phép cho vaccine ngừa COVID-19 của Novavax được sử dụng khẩn cấp ở người lớn. Đây là loại vaccine ngừa COVID-19 thứ tư được sử dụng ở Mỹ.
Vaccine của Novavax có cơ chế hai mũi tiêm dành cho người trưởng thành từ 18 tuổi trở lên.
Ủy ban tư vấn về vaccine độc lập và các sản phẩm sinh học liên quan của FDA đã bỏ phiếu ủng hộ việc cấp phép vaccine Novavax vào ngày 7/6. Loại vaccine này cũng đang được sử dụng ở 170 quốc gia khác.
Vaccine dựa trên protein của Novavax sử dụng một phần virus đã được can thiệp để thúc đẩy phản ứng miễn dịch. Kết quả thử nghiệm lâm sàng cho thấy vaccine của Novavax có hiệu quả 90,4% ngăn ngừa các bệnh nhẹ, trung bình và nặng từ việc mắc COVID-19. Novavax hồi đầu tháng 7 cũng thông báo vaccine của hãng này tạo ra phản ứng miễn dịch đối với các biến thể hiện nay của virus SARS-CoV-2 bao gồm BA.4 và BA.5.
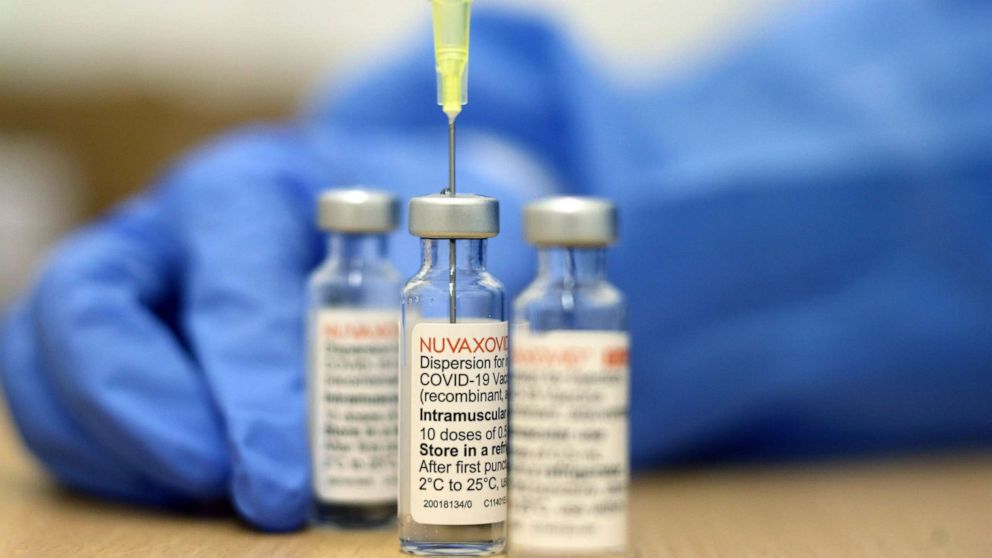
Dù đã được FDA phê duyệt, vaccine của Novavax vẫn cần phải được thông qua bởi Trung tâm Kiểm soát và Phòng ngừa dịch bệnh (CDC) Mỹ trước khi chính thức được đưa vào sử dụng tại quốc gia này. Ủy ban cố vấn độc lập của cơ quan này sẽ nhóm hộp và đưa ra khuyến nghị ngày 19/7.
Khoảng 1/3 người Mỹ vẫn chưa được tiêm vaccine ngừa COVID-19 với hơn 100 triệu người. Nhiều quan chức và nhân viên y tế hy vọng rằng một loại vaccine như của Novavax, sử dụng công nghệ quen thuộc hơn, có thể đủ thuyết phục những người đã do dự trong việc tiêm chủng.
"Chúng tôi tin rằng một số trong 100 triệu người đó đang chờ đợi vaccine của chúng tôi", Chủ tịch kiêm Giám đốc điều hành Novavax, Stanley Erck nói với CNN.
Ngoài loạt mũi tiêm chính, ông cho biết, công ty hy vọng sẽ sớm nhận được sự cho phép để sử dụng các mũi tăng cường của Novavax để bổ sung cho các loại vaccine khác. Ông Erck nói: “Chúng tôi đã trao đổi với FDA khá nhiều về vấn đề này. Tôi tin rằng FDA sẽ giải quyết sự chấp thuận đó trong vòng vài tuần".
Bích Thảo(Theo CNN)