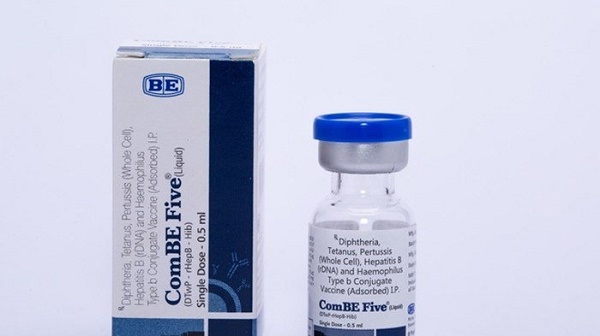
Chiều 12-6, theo tin từ Cục Quản lý dược (Bộ Y tế), dự kiến từ giữa tháng 6-2018, 833.200 liều vắc xin “5 trong 1” ComBe Five (do Ấn Độ sản xuất) phòng các bệnh: Bạch hầu, ho gà, uốn ván, viêm gan B, viêm phổi/viêm màng não mủ do vi khuẩn Hib thay thế vắc xin Quinvaxem sẽ được nhập khẩu về Việt Nam.
Theo kế hoạch cung ứng vắc xin cho Chương trình tiêm chủng mở rộng năm 2018 của Bộ Y tế, loại vắc xin DPT-VGB-Hib (vắc xin “5 trong 1”) được lựa chọn sử dụng là vắc xin ComBE Five(số Giấy đăng ký lưu hành: QLVX-1040-17; do Công ty Biological E, Ấn Độ sản xuất). Vắc xin này sẽ được sử dụng thay thế cho vắc xin Quinvaxem đã được sử dụng trước đây do hiện nay nhà sản xuất (tập đoàn Jassen tại Hàn Quốc) đã ngừng sản xuất loại vắc xin này trên toàn thế giới.
Vắc xin ComBE Five sẽ được sử dụng thay thế cho vắc xin Quinvaxem |
Theo thông tin từ Viện Vệ sinh dịch tễ Trung ương (ghi tại Công văn số 585/VSDTTƯ-TCQG ngày 04/5/2018), dự kiến giữa tháng 6/2018 sẽ có 833.200 liều ComBE Five (do GAVI viện trợ) được nhập khẩu về đến Việt Nam.
Để đảm bảo cung ứng kịp thời vắc xin “5 trong 1” cho Chương trình tiêm chủng mở rộng quốc gia và đảm bảo hiệu quả của công tác tiêm chủng, Cục Quản lý Dược đề nghị Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế:
1. Chuẩn bị sẵn sàng các điều kiện cần thiết để kịp thời kiểm định ngay sau khi nhận được mẫu vắc xin ComBE Five từ cơ sở nhập khẩu, đảm bảo đúng tiến độ kiểm định vắc xin theo quy định và đáp ứng đúng kế hoạch triển khai sử dụng vắc xin trong Chương trình tiêm chủng mở rộng.
2. Tăng cường giám sát chất lượng vắc xin ComBE Five trong quá trình vắc xin được đưa ra lưu hành, sử dụng, đặc biệt trong giai đoạn triển khai tiêm chủng trên quy mô nhỏ tại 7 tỉnh/thành phố trong tháng 6-7/2018 trước khi tổ chức triển khai chuyển đổi sử dụng vắc xin trên phạm vi toàn quốc (căn cứ Quyết định số 2912/QĐ-BYT ngày 14/5/2018 của Bộ Y tế về việc phê duyệt Kế hoạch sử dụng vắc xin DPT-VGB-Hib thay thế vắc xin Quinvaxem trong tiêm chủng mở rộng tại 7 tỉnh (Hà Nam, Bắc Giang, Yên Bái, Kon Tum, Bình Định, Đồng Tháp, Bà Rịa Vũng Tàu)), bao gồm các nội dung sau:
- Tăng cường kiểm tra, giám sát các cơ sở nhập khẩu, phân phối và các đơn vị tiêm chủng có bảo quản, sử dụng vắc xin ComBE Five.
- Tăng cường kiểm tra chất lượng (kiểm tra tính hiệu quả và an toàn) của vắc xin ComBE Five tại các cơ sở có bảo quản, sử dụng vắc xin ComBE Five.
- Tăng cường theo dõi, tổng hợp, phân tích và đánh giá xu hướng về tính ổn định của vắc xin ComBE Five sau khi đã được kiểm định và lưu hành trên thị trường.
Ảnh minh hoạ |
3. Báo cáo về Cục Quản lý Dược ngay sau khi có kết quả kiểm định các lô vắc xin ComBE Five trước khi đưa ra lưu hành cũng như trong quá trình vắc xin lưu hành trên thị trường, trong đó:
- Ghi rõ các nội dung sau: ngày nhận mẫu, số lượng mẫu, kết quả kiểm định, ngày có kết quả kiểm định đối với từng lô vắc xin ComBE Five được lấy mẫu.
- Đưa ra các khuyến cáo, kiến nghị đối với Bộ Y tế và các đơn vị có liên quan trong trường hợp vắc xin ComBE Five có vấn đề hoặc nghi ngờ có vấn đề về chất lượng, an toàn, hiệu quả.
- Gửi kèm văn bản thông báo kết quả kiểm định và phiếu kiểm nghiệm lô vắc xin được ban hành bởi Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế đối với từng lô vắc xin ComBE Five được lấy mẫu kiểm định.
4. Trong quá trình triển khai thực hiện, nếu có khó khăn, vướng mắc, đề nghị thông báo về Cục Quản lý Dược để được giải quyết theo quy định.
Thu Hà