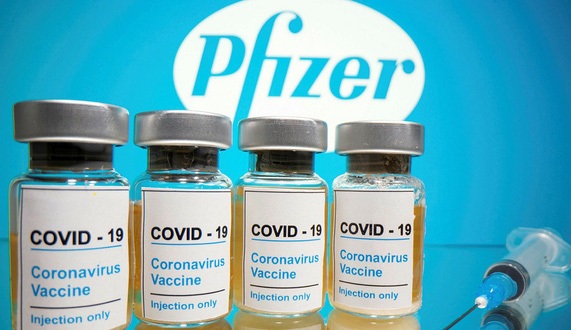
Ngày 12/6, bộ Y tế đã phê duyệt có điều kiện đối với vaccine Comirnaty của hãng Pfizer nhằm phục vụ cho nhu cầu cấp bách trong công tác phòng chống dịch COVID-19.
Đây là loại vaccine ngừa COVID-19 thứ 4 được bộ Y tế Việt Nam phê duyệt, sau vaccine AstraZeneca của Anh, vaccine Sputnik V của Nga và vaccine của Công ty Sinopharm (Trung Quốc).
Mỗi liều vaccine Comirnaty có 0,3ml chứa 30mcg vaccine mRNA COVID-19, được bào chế dưới dạng hỗn dịch đậm đặc pha tiêm. Mỗi lọ vaccine chứa 6 liều.
Bộ Y tế giao Cục Khoa học công nghệ và Đào tạo có trách nhiệm lựa chọn và hướng dẫn, chỉ đạo đơn vị có đủ điều kiện đánh giá tính an toàn, hiệu quả của vaccine trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vaccine, sinh phẩm y tế của Bộ Y tế trong quá trình sử dụng.
Cục Y tế Dự phòng thực hiện các trách nhiệm liên quan đến tiêm chủng vaccine Comirnaty. Bộ Y tế cũng giao Viện Kiểm định Quốc gia vaccine và sinh phẩm y tế có trách nhiệm tiến hành kiểm định và cấp Giấy chứng nhận xuất xưởng lô vaccine Comirnaty trước khi đưa ra sử dụng.
Trong quyết định của Bộ Y tế nêu rõ: Các điều kiện đi kèm việc phê duyệt vaccine Comirnaty dựa trên dữ liệu an toàn, chất lượng và hiệu quả do Công ty TNHH Pfizer (Việt Nam) cung cấp cho bộ Y tế Việt Nam tính đến ngày 28/5/2021, cùng với đó là cam kết của Công ty TNHH Pfizer (Việt Nam) về việc các tài liệu đã cung cấp cho bộ Y tế Việt Nam cũng đồng thời là tài liệu Công ty TNHH Pfizer (Việt Nam) đã nộp và đánh giá, phê duyệt bởi EMA.
Trước đó, hồi giữa tháng 5, bộ Y tế đã đàm phán thành công với nhà sản xuất vaccine Pfizer về việc cung ứng cho Việt Nam 31 triệu liều vaccine. Trong đó 15,5 triệu liều cung cấp trong quý 3-2021 và nửa còn lại cung cấp trong quý 4-2021. Lô vaccine đầu tiên của Pfizercó thể về Việt Nam trong thời gian từ nay đến tháng 7/2021.
Hoa Vũ (T/h)